Ⅳ 「衣・食・住」を化学する!!
1 「衣」について2
1 繊維の基礎
(1) 繊維の種類と性質
(2) 実験1 繊維の種類と燃え方の違い
2 色の分離と色素の基礎
(1) 色の物理・色の化学
(2) 実験2 ペーパークロマトグラフィーによる色素の分離
3 染色について
(1) 色々な色素と染色
(2) 実験3 玉ねぎの皮による染色(媒染)
(3) 実験4 藍の化学建てによる染色
今回は「Ⅳ 「衣・食・住」を化学する!!」の2回目、「衣」について染色を中心に学習しました。前回、衣服を構成している繊維について、どうやって作るのか、どういう性質があるのか学び、実際にペットボトルを使って繊維を作ったり、いろいろな繊維の強さを調べたりしました。今回のテーマは「色」です。衣服のほとんどに色や模様がついています。そもそも、どうして色がついて見えるのでしょうか?服に色をつけるにはどうすればよいのでしょうか?繊維の性質を振り返りながら、実験をとおして、繊維と色について理解を深めていきます。
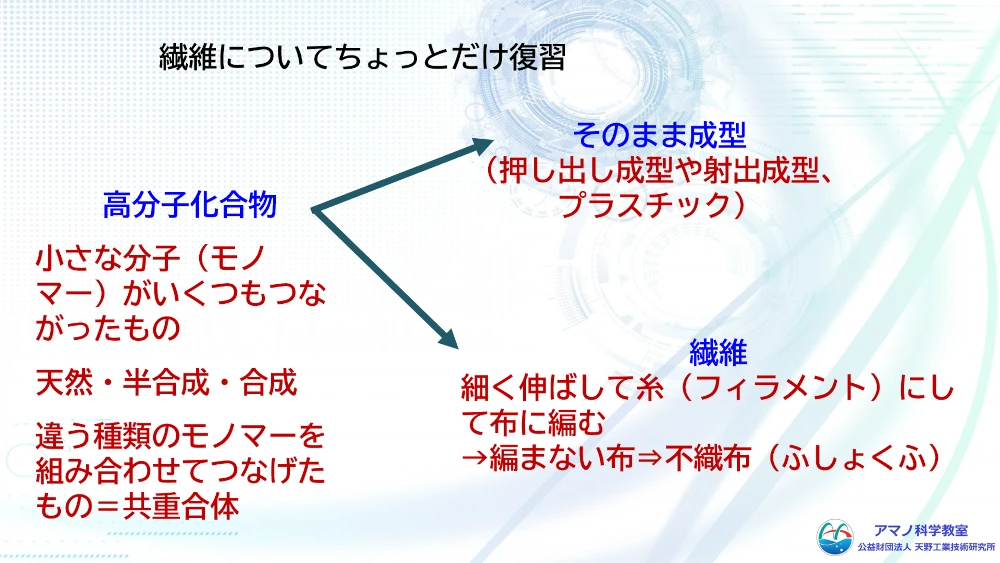
1 繊維の基礎
(1) 繊維の種類と性質
繊維について復習しました。繊維は高分子化合物でできています。塊やシート状に成型したものはプラスチック製品と呼ばれ、糸状に加工したものは繊維素材、これをつかって布等にしたものは繊維製品と呼ばれています。原料は木綿や麻などの天然素材のほか、石油から合成された合成高分子、天然素材を化学的に加工した半合成高分子などが用いられていて、その触感も風合いも異なり、吸湿性やドレープ性などさまざまな特徴があります。

繊維見本を実際に触ってその特徴を感じてみました
(2)実験1 繊維の種類と燃え方の違い
いくつかの繊維の切れ端を実際に燃やしてその性質の違いを確認しました。木綿、麻、羊毛、絹、レーヨン、ナイロン、ポリエステルを5mm幅くらいの短冊に切って、ピンセットでつかみ、ライターで火をつけて、燃え方、においなどを実際に確認してみました。


木綿や麻は天然のセルロースからできていて、よく燃え、特別に特徴的なにおいはしません。羊毛や絹も燃えますが、燃えると髪の毛が焦げたようなにおいがします。これは、羊毛や絹がタンパク質からできているからで、特に羊毛は人間の髪の毛と同じ、ケラチンというたんぱく質でできているためです。
合成繊維である、ナイロンやポリエステルも燃えますが、火をつけると縮んで融けながら黒いすすを出してよく燃えます。
合成繊維には燃えますが、酸素不足になってすすが出ます。燃えるということをとってみても繊維によってこんなに違うことにびっくりしました。
2 色の分離と色素の基礎
(1) 色の物理・色の化学
繊維の染色について学習する前に、色について学びました。どうして色がついて見えるのか考えてみます。物体の色が見えるためには、光が必要です。物体自体が光を出しているか、物体に光があたって反射しているか、いずれかによって光が人間の目に入った時に、網膜にある錐体細胞がその色を検知します(明るさは桿体細胞が主に検知する)。
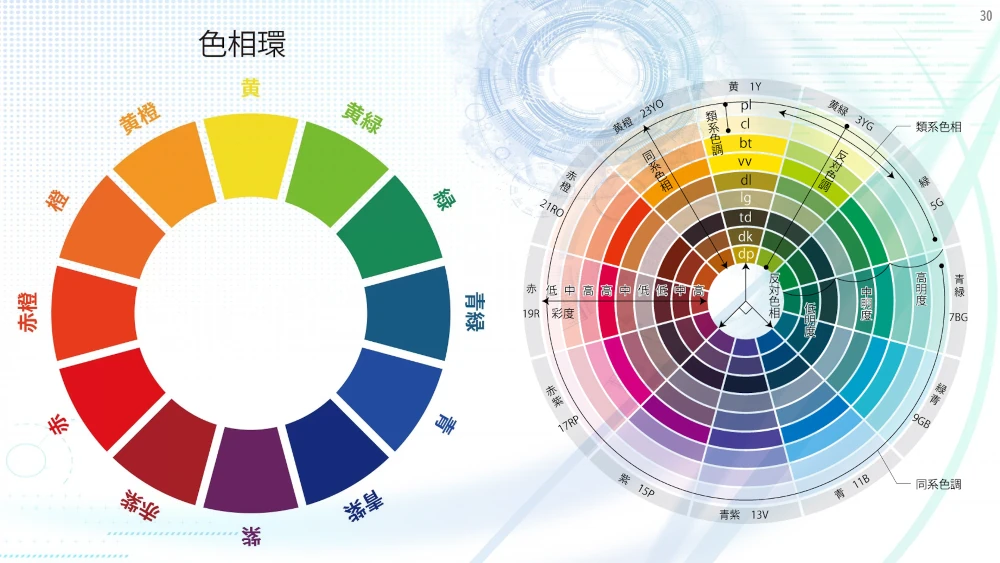
物体を作っている物質に可視光以上のエネルギーをもった光があたると、その光のエネルギーは、物質を構成する分子や原子の電子励起に使われます。太陽や蛍光灯などの電灯の明かりは、いろいろな色の光が混合しています。この光が物体にあたり、反射して眼に届く光は、電子励起に使われなかった残りの光になります。例えば、赤いリンゴは、実は緑色を中心に吸収していて目には、電子励起に使われなかった赤色の光を中心に届くので赤く見えます。この関係は補色といい、色相環を使うとその関係がよく分かります。
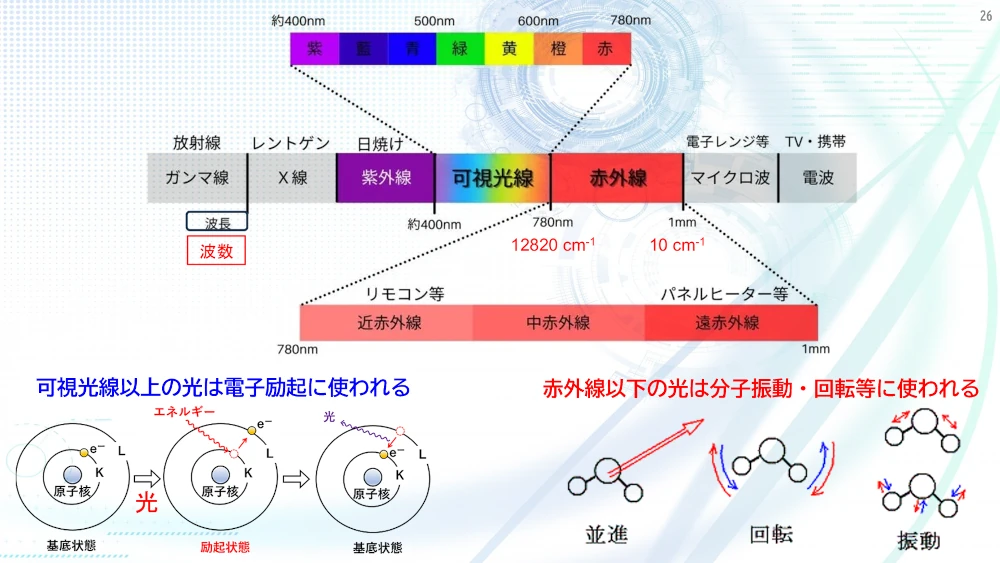
可視光線よりエネルギーが低い光、例えば赤外線は、電子励起ではなく、振動に使われ、物質が温まるのに寄与しています。この仕組みを理解すると物体がどうして色がついて見えるのか分かるようになります。
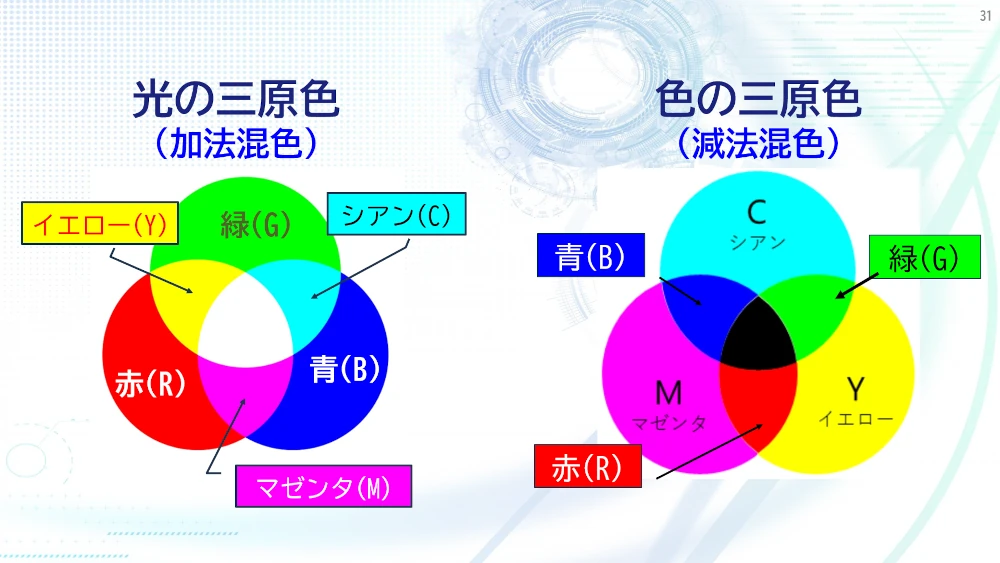
赤色の光、緑色の光、青色の光を混合すると白色になります。これを光の三原色と呼びます。ディスプレーはこの混色によってさまざまな色を作り出しています。ノーベル賞を受賞した青色発光ダイオードの発明によって電灯のLED化が急速に進みました。一方、絵の具など、光を吸収することで見える色は、混ぜれば混ぜるほど光を吸収して暗くなります。
シアン、マゼンタ、イエローを混色すると黒になります。これを色の三原色と呼びます。
(2)実験2 ペーパークロマトグラフィーによる色素の分離
簡単に色素を分離する方法として、ペーパークロマトグラフィーがあります。実際に、この方法を使って、水性ペンなどの色を分離し、身近にある色のついたものが、果たして一色なのか、いくつかの色を混ぜて作られているのか調べました。


ペーパークロマトグラフ用のろ紙を20cmの長さに切って、端から2cmのところに鉛筆で線を引きます。ここに水性ペンなどの色素を少量つけます(1mm~2mmくらいのスポット)。上部を切り取ったPETボトルに水を入れ、この中にろ紙を吊り下げます。水がしみて上昇していくと、これに追従して水性ペンの色素が上がっていきます。色素によって、ろ紙や水との親和性が違うため、色素は分離します。水をアルコールや食酢に変えて展開すると色の分離の状態が変わります。それぞれの色が水に溶けやすいか、アルコールに溶けやすいか、酸性になると構造がなど変化するかなどで、分離が大きく変化していきます。


黒や茶色など、暗い色はいくつもの色素が混ざってできていました。蛍光ペンのインクもペーパークロマトグラフィーで分離しました。確認には、紫外線を出すLEDライトを使いました。蛍光色素が紫外線LEDをあてると光ります。蛍光ペンもいくつもの色素が混ぜられていました。
洗濯用の洗剤も分離してみました。あまり展開しませんでしたが、紫外線をあてると驚くほど青白く光りました。洗剤のボトルには蛍光増白剤と書いてあります。太陽の光があたると、その中の紫外線で蛍光を発して、さらに白く見えます。色素にもいろいろな種類がありますが、こういうところにも特殊な色素が使われていることがわかりました。
3 染色について
(1) 色々な色素と染色
色がついてみえる仕組みは学びました。次に、実際の繊維はどのようにして色をつけているのか学習しました。繊維に色をつける材料を染料といいます。これには、天然もしくは合成されたものが使われます。天然染料の代表的なものは藍です。合成染料には染める繊維の種類や用途に応じて色々なものが作られています。
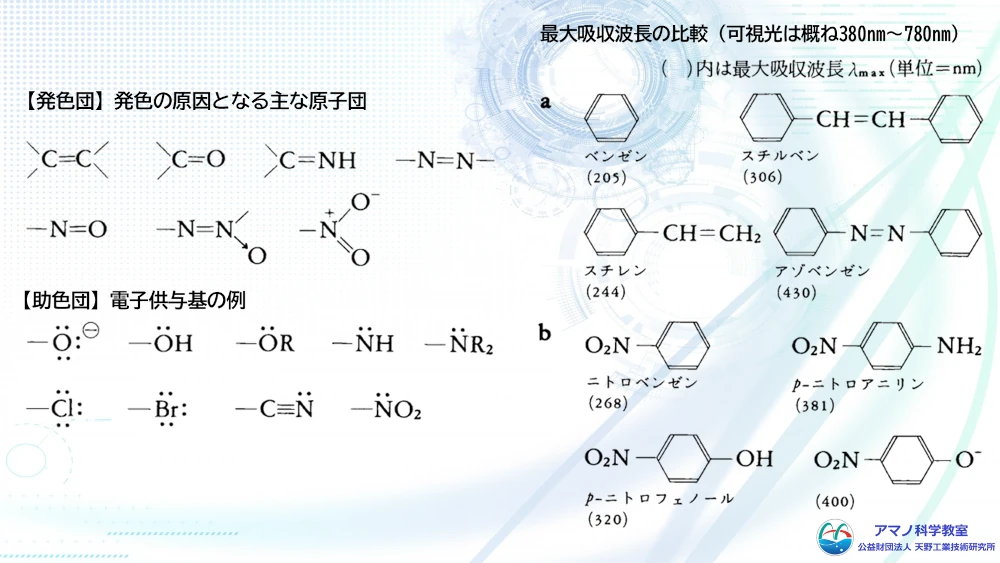
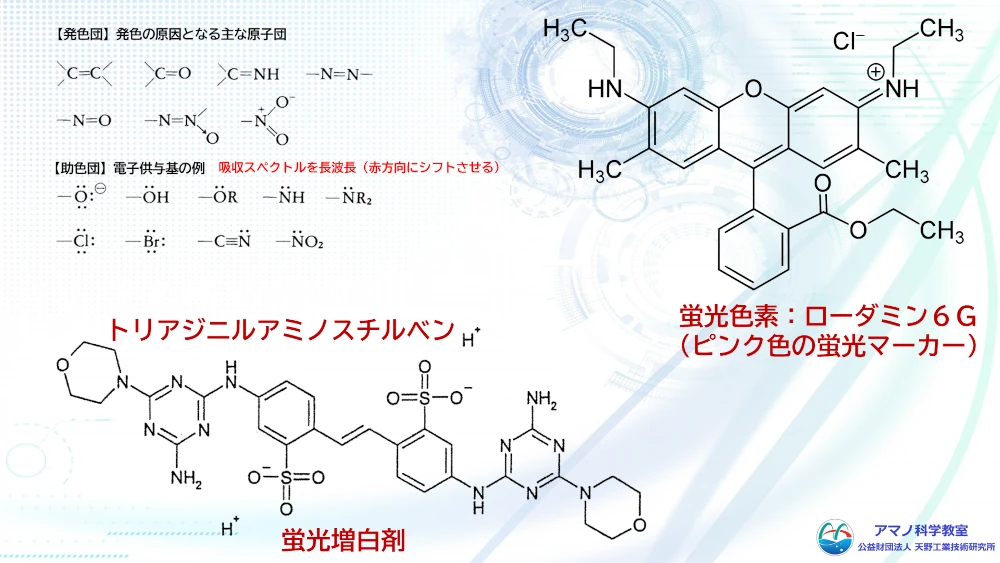
可視光線が物質にあたったとき、電子が励起されることで色がついてみるということは学習しました。可視光線によって電子励起が起こるようにするためには、電子が軌道から外れやすい構造をとる必要があります。炭素間の二重結合や、ニトロ基、カルボニル基、アミド基、アゾ基など二重結合をもつ構造の場合、電子が軌道間を遷移しやすくなります。この構造が多ければ多いほど、そして共役と呼ばれる二重結合が交互に続く構造になるほど、低いエネルギーで電子励起が起こるようになります。
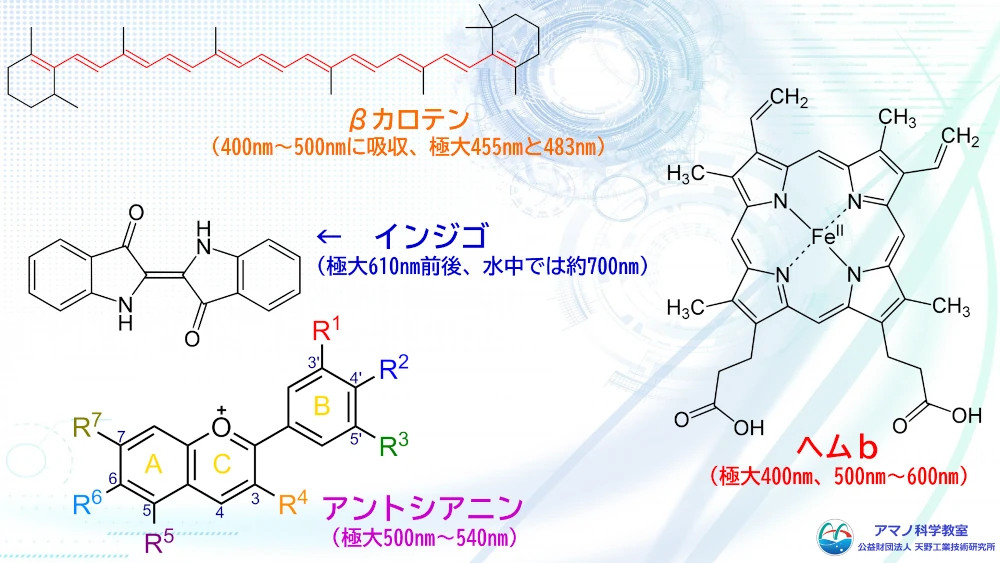
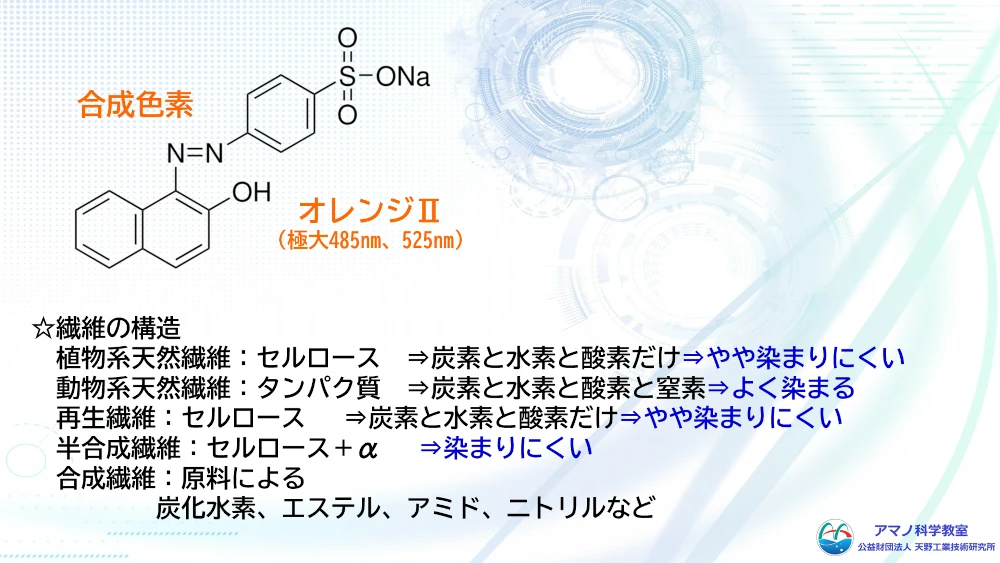
例えば、ニンジンの色素であるβカロテンは、炭素と水素だけの化合物ですが炭素ー炭素の二重結合が交互につながっています。これによりエネルギーの大きな青色を中心とした可視光を吸収するため、補色であるオレンジ色に見えています。色がつくための電子励起に必要な原子団を発色団と呼びます。さらに、水酸基やシアノ基、アミノ基など、発色団に結合して、色を強めたり、吸収波長を変化させたりする原子団は助色団と呼ばれます。発色団や助色団を持つ構造によって、物質は可視光線を吸収し、その構造に応じた色を呈するようになります。この仕組みを応用して、物質の構造に発色団や助色団を導入して染料が作られています。繊維の種類によって、その化学構造から染色されやすい繊維と染色されにくい繊維に分かれます。
(2) 実験3 玉ねぎの皮による染色(媒染)
実際に繊維を染めてみました。最初に、玉ねぎの外皮に含まれるケルセチンを使って、木綿を染めてみました。

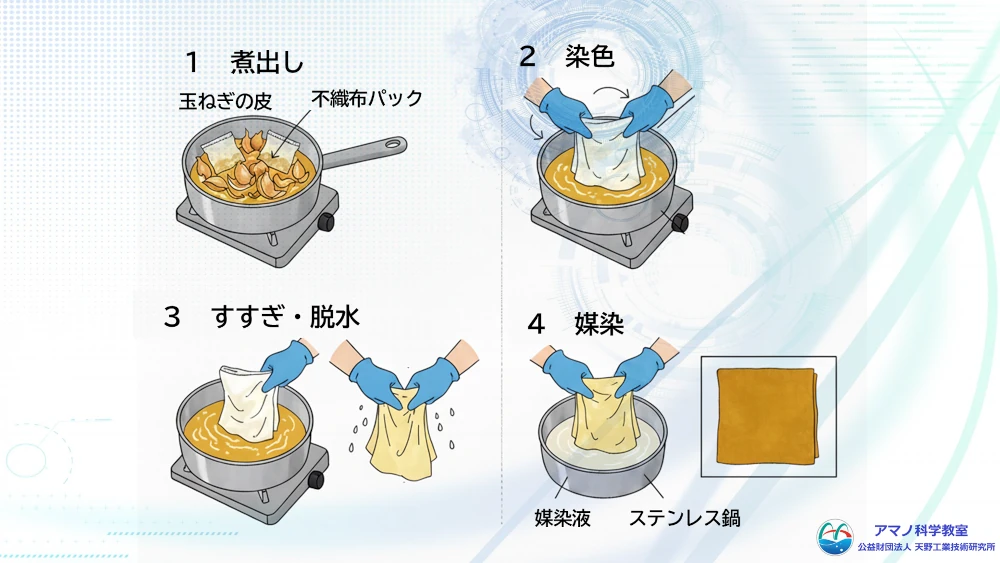
玉ねぎの皮をお茶パックに入れ煮出します。見る見るお湯が黄色から赤茶色になっていきます。この煮出し液に木綿を入れます。ケルセチンはタンパク質と良く結合しますが、木綿はセルロースなので羊毛や絹ほど染まりません。

木綿でも濃く染まり、色あせしないように、予め木綿を豆乳に浸けてタンパク質を浸み込ませておきました。さらに染色後に、ミョウバンの水溶液につけました。これは媒染と呼ばれ、ミョウバン中のアルミニウムイオンがセルロースとケルセチンの両方に結合する性質を利用して色素を繊維に定着させています。
また、せっかく染めるので、布に模様をつけるためにビー玉を木綿に挟んで輪ゴムで縛りました。輪ゴムで縛ったところは色素が入り込まないので白く染め残ります。
玉ねぎの皮の量で色の濃さが変わります。また、ミョウバンで媒染することで色が鮮やかになりました。模様もきれいにつけられ、身近な玉ねぎの皮でこんなに簡単に染色できることが分かりました。
(2) 実験4 藍の化学建てによる染色
最後に、藍染を行いました。藍は昔から使われている天然の染料です。タデ科の植物、タデアイからとった染料ですが、不思議なことに植物のタデアイを調べてもどこにも藍色は存在しません。昔の人たちは、この全く藍色をしていない植物を使って藍色に染める方法を発見しました。

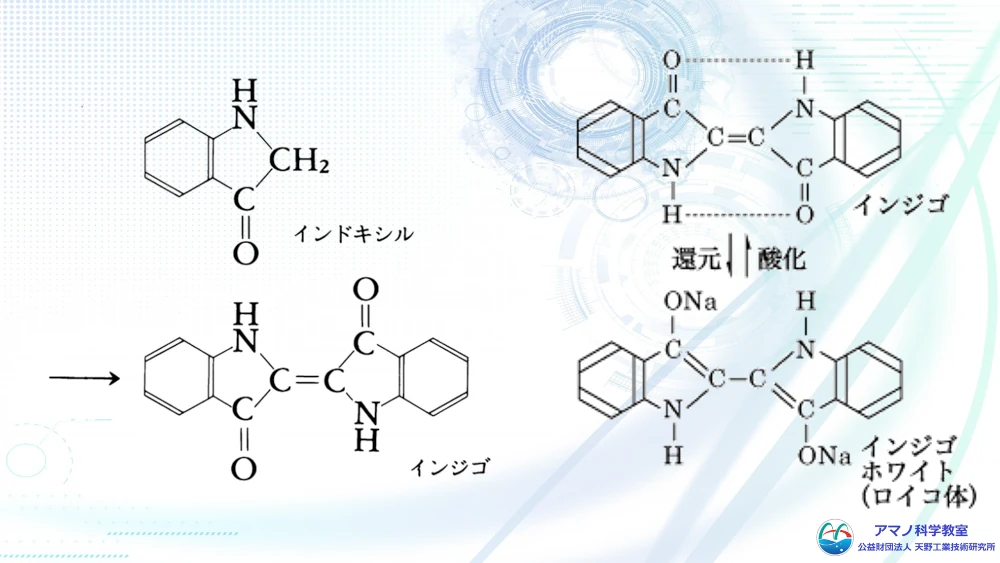
藍は、インジゴという化合物で水に溶けません。植物のタデアイ中には、インジゴの原料となるインドキシルという化合物がグルコースが結合したインジカンの形で存在しています。これを酵素の力で分解し、インドキシルに変えてさらに空気で酸化させるとインジゴができます。しかし、インジゴは水に不溶なため染色に使えません。そこで、微生物で発酵させてインジゴを還元し、ロイコ体という水に溶ける形にしたものが藍染に使う染色液になります。

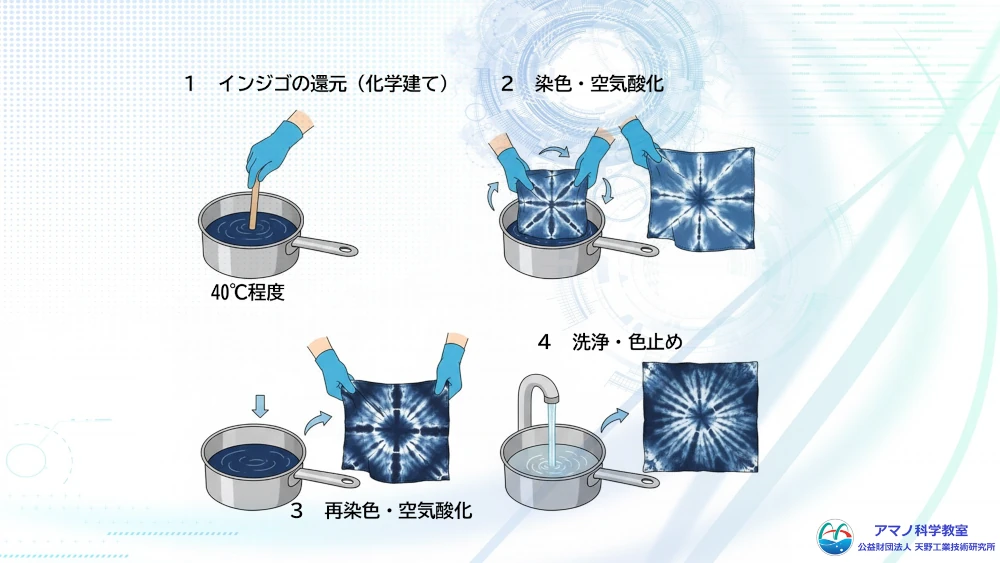
教室では発酵させる時間が取れないので、ハイドロサルファイトという薬品でインジゴを還元し、ロイコ体に変えました。インジゴを水に分散させ、重曹とハイドロサルファイトを加えそっとかき混ぜて待つとインジゴが溶けていきます。色も青から緑がかってっていきます。染色液の出来上がりです。
玉ねぎの皮染めの時と同じように、輪ゴムとビー玉で木綿のハンカチを絞って、模様を作ります。さあ、染色です。
染色液に浸けたばかりの木綿は全然藍色ではなく、むしろ緑色ですが、空気に触れると見る見る藍色になっていきます。何度か、浸けて外に出して空気に触れさせることを繰り返すと、どんどん濃い藍色になっていきます。染色が終わったら取り出して水洗いです。
そのまま流しに流さないようにバケツの水で洗って余分な染料を落としてから、仕上げに水道でよく洗います。絞った白い模様とコントラストのあるきれいな藍染ができました。化学反応を利用した染色。先人の知恵に感激しました。
今回は、色について学習しました。どうして色がついて見えるのか。電子の励起によるものだと分かりました。染料はこの電子励起が起こるように発色団に助色団を組み合わせるなどして、作られていることも分かりました。身近な、果物の色、紅葉の色もこうした構造によって色がついています。日常目にする現象も化学的な知識や実験による確認で、さらに理解が深まりました。









