Ⅲ エネルギーを考える!!
3 代替エネルギー
1 電池の化学
(1) 電気とは何か・電池とは何か
(2) 太陽電池を使ってみる
(3) ボルタ電池を作ってみよう
(4) くだもの電池・やさい電池を作ってみよう
2 新しい電池について
(1) 燃料電池を作ってみよう
(2) 色素増感太陽電池を作ってみよう
「Ⅲ エネルギーを考える!!」の3回目、電池について化学の眼で探究していきます。私たちの生活は電気なくして成り立ちません。家庭のコンセントにプラグを差せば当たり前に電気が使え、スマホをはじめ、多くの機器が優れた電池のおかげで機能を停止することなく様々な役割を果たしています。しかし、その仕組みはどうなっているのでしょう。今回は、電池のしくみ、そして未来の電池について、実際に作ってみて、化学的に考察していきます。
1 電池の化学
電池を発明したのはイタリアの物理学者ボルタです。電圧の単位Vは彼の名前にちなんでいます。同じ時代、ガルバーニはカエルの神経の実験で2つの異なる金属にカエルが接触するとかえるの筋肉がけいれんを起こす現象を発見し動物電気と名付けました。ボルタはこれに疑問を持ち、動物でなくても、2つの金属と食塩水や硫酸でも電気が発生することを見つけました。これが化学電池の起源です。今回の講座では、電気の正体は何か?と、知っている電池は何か?の2つを課題としました。


電池の仕組みを学習するのは中学3年生の理科です。少し難しい課題だったかもしれませんが、考えることが大切です。

実験をとおして、実際にいくつかの電池を作ってみながら、電池の仕組みを学び、さらに次世代の電池についても体験していきます。
電気の正体は何でしょうか?電気は電子の流れが引き起こす現象です。電池はこの電子のながれを作るポンプの働きをしています。
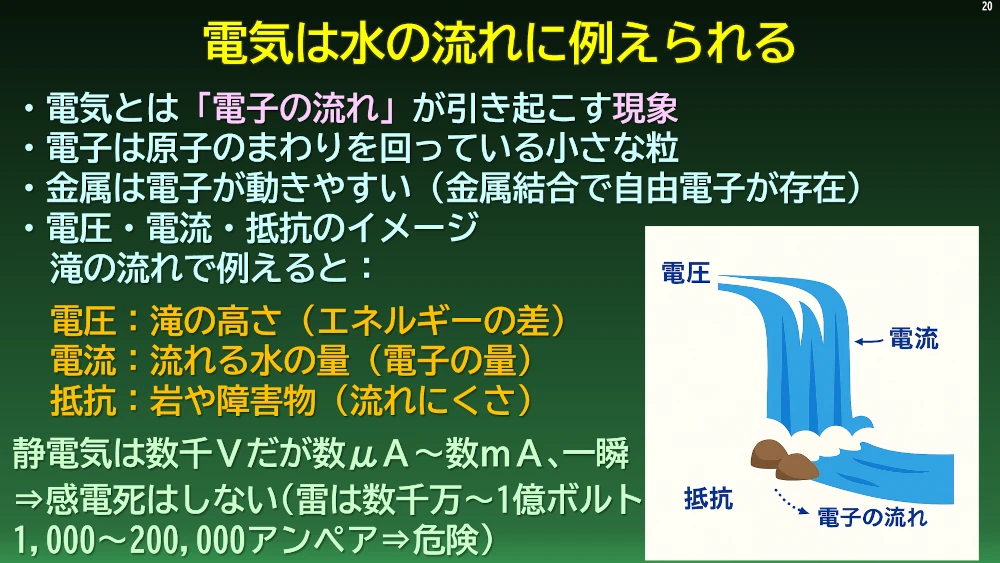
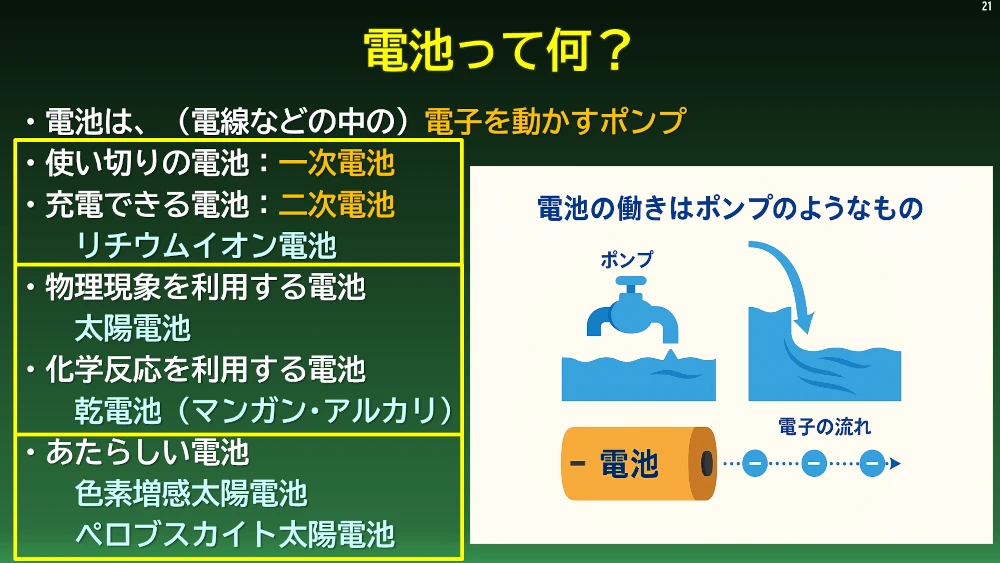
電子は私たちの周りに存在します。私たちの身体を作っている原子も、その原子核の周りに電子が存在しています。いたるところに電子は存在しますが、この電子を電気として簡単に取り出せる物質と取り出せない物質があります。また、光や振動といった物理エネルギーによって電子を取り出し、流れを作ることのできる電池と、ボルタ電池のように化学反応のエネルギーによって電子を取り出し、流れを作ることのできる電池があります。物理エネルギーを電気に変える電池を物理電池、化学エネルギーを電気エネルギーに変える電池を化学エネルギーといいます。


電気が発生しているかどうか確かめるために、テスター、ミュージックIC、LED、プロペラ付きモーターを用意しました。これらの使い方に慣れるため、最初に小さなソーラーパネル(多結晶シリコンパネル)を使って、発電の状況を観察しました。ソーラーパネルは光エネルギーを電気エネルギーに変換します。
あいにくの曇天でしたが、青色LEDも点灯、明るい所へ持って行ったり、照明をあてるとモーターも回りました。
では、いよいよ電池の作成に挑戦です。まずボルタ電池。今回は安全のため、クエン酸水溶液を電解液に使いました。いろいろな元素や化合物の中で電子を取り出しやすいものとして金属が挙げられます。金属は金属結合という結合をつくり、電子は自由電子として金属原子が並んでいる結晶の中を自由に動いています。
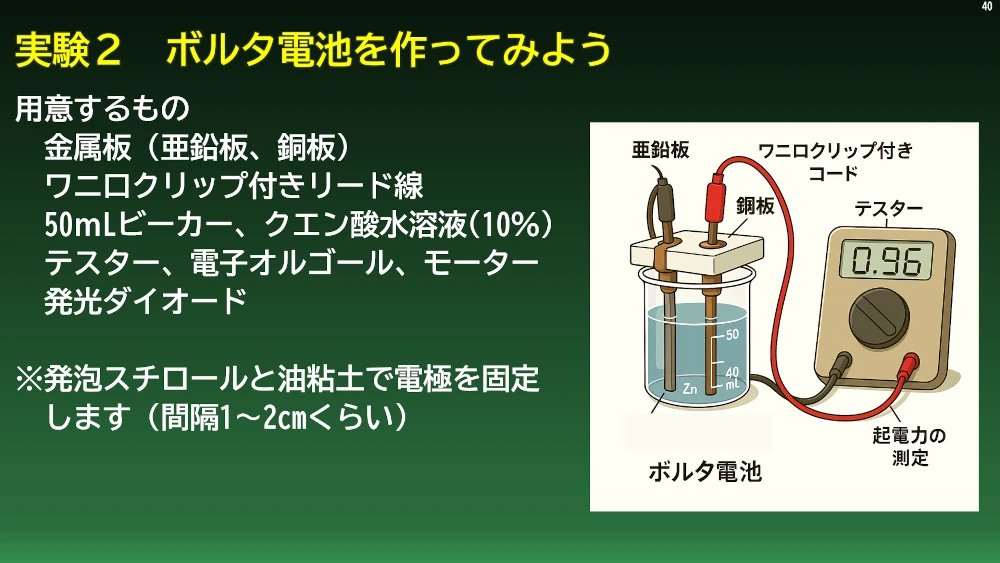
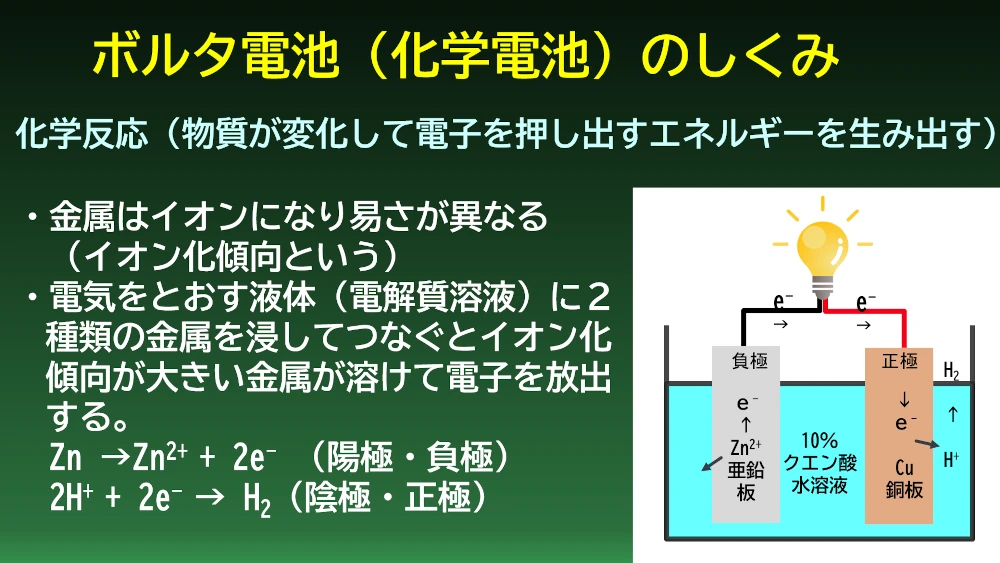
金属によっても電子の出しやすさ(つまりイオンへのなり易さ)は異なります。このイオンへのなり易さをイオン化傾向、イオンになり易い順に金属元素を並べたものをイオン化列といいます。イオン化傾向の大きい金属と小さい金属を電子やイオンを運ぶことができる電解質溶液と呼ばれる液に浸し、導線でつなぐと、イオン化傾向の大きい金属がイオンになって電子を出し、その電子はイオン化傾向の低い金属へと流れていき、電解質溶液中の水素イオンを還元して水素に変えます。これがボルタ電池の仕組みです。ボルタ電池では負極に亜鉛板、正極に銅板を使っています。早速ビーカーにクエン酸水溶液をつくり、亜鉛板と銅板を浸してボルタ電池を作りました。
イオン化傾向の大きい小さいだけでは、金属の組合せでどの程度の起電力が期待できるか分からないので、水素を基準とした標準電極電位というものが様々な金属について実験で求められています。亜鉛と銅の組合せは1.1V程度ですが、これは上限で、使用する電解質によって実際には結果は変わっていきます。
ボルタ電池の応用です。ビーカーとクエン酸水溶液を、果物や野菜に置き換えて電池を作ってみました。

何人かで、直列にしたり、同じくだものに何枚も金属板を差したり、金属板も何種類も用意したので組み合わせを変えたり、いろいろな試行がスタートしました。
定番のレモン、じゃがいもは意外と優秀、ナス、トマト、ミニトマト、オクラも発電しました。大根もOK。なし、バナナも発電しました。
電極の組合せやくだもの、野菜の種類などを変えて結果を整理するとどんなことが分かるでしょうか。とても興味深い実験です。
2 新しい電池について
新しい電池について実験しました。まず、燃料電池。最近、燃料電池で走る自動車が実用化されたり、家庭用の燃料電池が普及してきたりして、聞いたことのある人も多いと思います。燃料電池とはどいうものでしょうか。

燃料電池は、簡単に言うと電気分解の逆、水を電気分解すると、水素と酸素が発生しますが、水素と酸素が反応する過程で電気を得るものです。水素は結果的に酸素と反応して水になり、この燃料(水素)を連続供給すれば、空気中の酸素を使って電池として機能し続けます。化学講座の実験では安全性も考慮して、マグネシウムを燃料に使うマグネシウム燃料電池を作りました。マグネシウムは空気中の酸素を消費して水酸化マグネシウムとなっていきます。マグネシウムを連続供給すれば発電し続けます。
ボルタ電池に比べて起電力も大きく、余裕でモーターを回すところまでたどり着きました。起電力も低下しません。優れた電池と言えます。特に、水素を燃料とした場合は、発生するのは水だけで、反応熱でお湯になるので、この熱も利用できて、かなりエコな電池です。
最後に、次世代の電池、色素増感太陽電池の製作に挑戦です。電極には、半導体電極として知られる酸化亜鉛や酸化チタン微粉末を塗布した電極とカーボンの電極を使います。
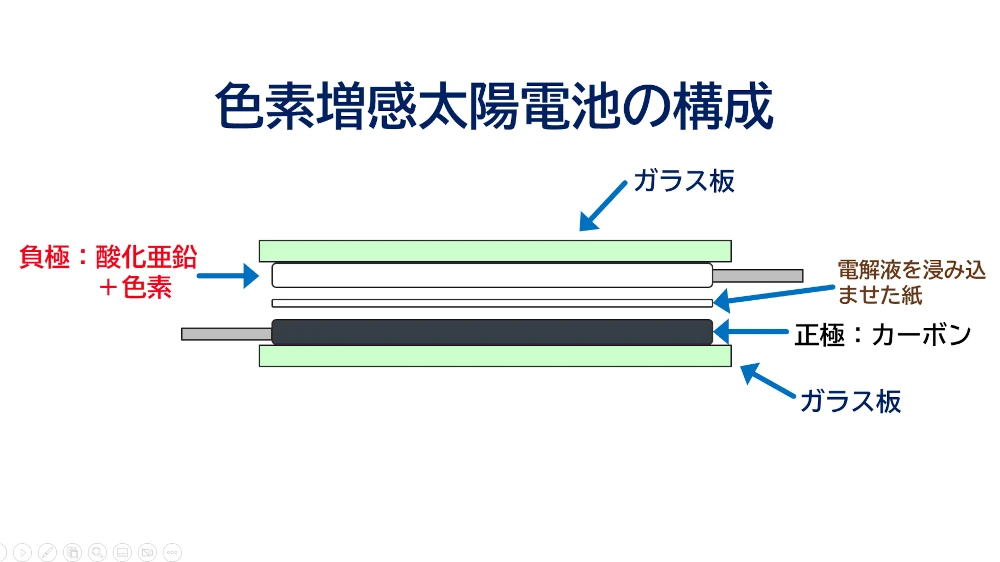

酸化チタンや酸化亜鉛は、光をあてると電子を発生しますが、紫外線が必要ですし得られる電流は大きくありません。しかし、この酸化亜鉛や酸化チタンに色素を吸着させると、色素は可視光線を吸収して励起し、効率よく電子を酸化亜鉛や酸化チタンに受け渡し、電流は大幅に増えます。これが色素増感太陽電池の仕組みです。色素の種類を変えるとカラフルな太陽電池ができます。また、部屋の蛍光灯下でも発電し、薄く、軽量で曲げることができる電池を作ることができます。電解質のヨウ素は正極で電子を受け取り、色素に電子を戻して再生する働きをしています。早速作ってみました。今回は酸化亜鉛を塗布した電極と濃い黒の鉛筆の芯を塗布した電極を使い、色素にはハイビスカスティーやブラックベリー、ラズベリー、ブルーベリーを用意しました。
電圧は0.4V前後でモーターを回したりLEDを点灯するには不足していますが、直列にすることで解決できます。ハイビスカスティを抽出した濃い赤色の液を吸着させると、酸化亜鉛の表面は白から薄い青色に変化しました。可視光線のオレンジを中心に吸収して発電していると考えられます。
日当たりの良いところにもっていくと起電力はさらに上がります。何よりも電池を製作する操作がとても簡単で、色素を変えるとどうなるかも興味のあるところです。ブラックベリーで挑戦した受講生がいました。ハイビスカスティにくらべ若干、電圧が下がるようでした。天然色素を使って発電するこの電池、すごいと思います。
今回は、電池の化学について学習しました。ボルタによる電池の発見以来、化学電池も物理電池も発展し続けています。この過程には日本の化学者も大きな貢献をしています。










