Ⅲ エネルギーを考える!!
2 燃焼について
1 燃焼とは
(1) 燃焼を化学の眼で見ると
(2) 燃焼の三要素
(3) ろうそくの観察からわかること
(4) 燃焼のパターン
2 燃焼による物質の変化
(1) 金属の燃焼
(2) 燃焼による質量変化
(3) 燃焼と活性化エネルギー
3 酸化反応と発熱
(1) 使い捨てカイロを作ろう
(2) 化学反応と触媒
「Ⅲ エネルギーを考える!!」の2回目、「燃焼について」化学の眼で探究していきます。燃焼=ものが燃えることは、私たちの生活のなかでとても身近なことです。人間は火を扱うことで衣食住だけでなく文明を発展させてきました。オール電化の家も増えてきましたが、火の力なくして私たちの生活は考えにくいものです。今回は、燃えること=燃焼について、いくつかの実験を交えて化学的に洞察していきます。
1 燃焼とは
燃焼を科学的に解明したのは、「近代科学の父」フランスの化学者ラボアジェです。
ラボアジェの時代。ものが燃焼ことは、燃素(フロギストン)が出ていくことだと信じられていました。しかし、燃焼によって質量が増えることを実験で確認し(スズの燃焼と言われています)、このフロギストン説に疑問を抱きました。実験を重ね、燃焼が酸素との反応であることや質量保存の法則を発見しました。

「燃焼は熱や光を出しながら急激に進む酸化反応」です。では燃焼には何が必要で、どのような特徴があるのでしょうか。いくつかの燃焼を観察しながら確かめました。

ろうそくの炎を観察してみました。ろうが燃焼する様子から燃焼のことが少しずつわかってきます。机の上に耐熱シートや耐熱板を置き、その上に長さや太さの違う、ろうそくを何本か立てました。保護メガネやマスクも用意しました。軍手をしてやけどに注意してさあ実験です。
まず、ろうそくの炎を観察してスケッチしてみます。よく見るといろいろなことに気が付きます。芯の下でろうそくのろうが溶けています。


ろうそくの炎は色の違う3つの部分に分かれているようです。芯に近いところは暗いオレンジ、その外側は黄色、そして一番外側は明るく白に近い黄色で、その周りは青色に見えます。
ろうそくを立てた経験はあまりないみたいですが、みんな、ろうを溶かして接着剤代わりにしたり、工夫してろうそくを立てました。ところで、燃えているろうは何からできているのでしょうか。ろうには大きく分けて、石油が原料のものと、動物や植物が由来のろうの2種類があり、化学的にはこの2つは大きく異なります。
石油系のろうは、直鎖炭化水素、前回の講座で学習しました。炭素と水素だけからできています。動植物由来のろうは、酸やアルコール、その化合物エステルでできています。分子の中に酸素を含み、すすが少ないと言われています。燃やすと最終的には二酸化炭素と水になります。


石油系のろうそくの燃焼でどれくらいの熱が出るか計算してみます。1molのノルマルエイコサンを燃やすと20℃、40lの水をすべて沸騰させることができます。同時に、448リットルの二酸化炭素が発生し、378の水ができます。
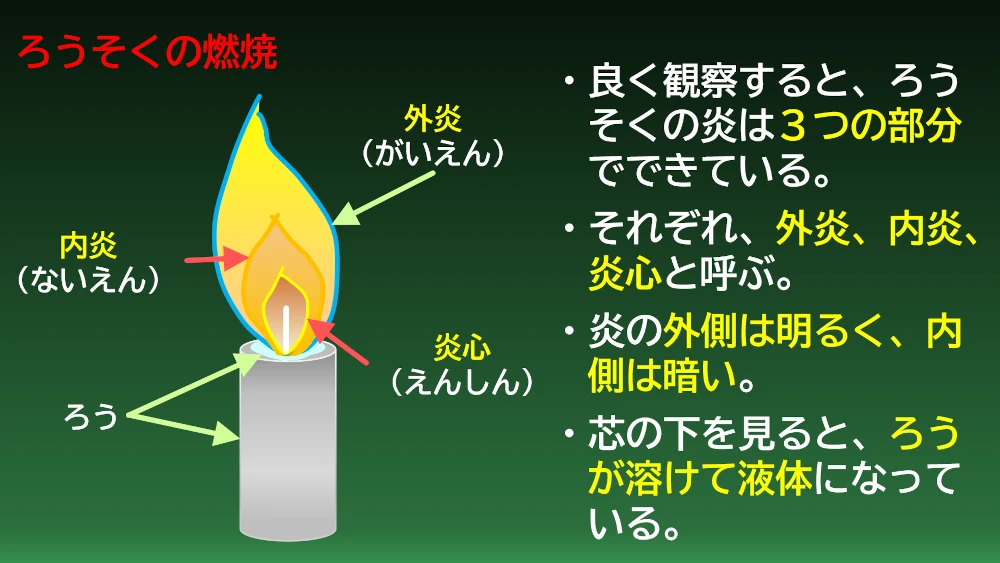
ろうそくの炎は中心部分の炎心、その外側部分の内炎、一番外側の外炎の3つの部分に分かれているようです。外側は明るく、中心部ほど暗いことが分かります。また、蝋は炎の熱で溶けて液体なって芯の下にたまっています。溶けたろうは芯を吸い上がり、燃えているようです。もう少し観察してみます。
炎の中に、①たけひごを差し込む、②アルミ箔を入れてみる、③アルミのチューブを差し込んでみる、④ビーカーをかぶせてみる。

竹ひごは、外炎部分が特に焦げ、まだらになりました。アルミ箔を炎の中心に入れると黒いすすがいっぱいつきました。アルミのチューブを炎心に差し込むとろうの白い蒸気が出てきます。ライターの火をあてると一瞬燃えます。ビーカーをかぶせると湯気で内側が曇りました。一連の観察からいろいろなことが分かります。
ろうは、溶けて芯を吸い上がり、蒸気になって燃えていました。燃焼によって水ができています。炎の外側にいくほどたくさんの空気(酸素)と接するので温度が高くなっています。中心部は酸素不足で、不完全燃焼になり燃え残った炭素がすすになっています。ビーカーをかぶせたままにすると湯気も付きますが、ろうそくの火が消えてしまいます、燃焼には酸素が必要です。
さらに観察、水を張ったトレイの上でろうそくに火をつけ、ビーカーをかぶせると水が吸い上がっていきます。2本の長さの違うろうそくに火をつけてビーカーをかぶせると、なんと長い方のろうそくが先に消えます。二酸化炭素は重いので下にたまり短い方が先に消えると思ったのに…さあ、なぜだろう考えます。
ろうそくの観察からわかったことをまとめました。可燃物が燃焼するパターンについても学習しました。紙や木も直接燃えているのではなく、分解して気体になって空気と混ざり燃焼しているんですね。


2 燃焼による物質の変化
次に燃焼によってどのような変化が起こるか調べました。課題の答えの中で、燃えないものの例に金属を挙げた人が何人もいました。一方、燃えるものの例に金属を挙げた人もいました。どちらしょうか?鉄とマグネシウムに火をつけてみました。
マグネシウムはまぶしい光を出して燃えました。綿状になった鉄(スチールウール)もぱちぱちと火花を散らしながらオレンジ色の光を出してゆっくりと燃えていきました。金属も燃えることが分かりました。では、燃焼前後で質量はどうなるでしょうか?天秤を用意して、燃える前と燃えた後のスールウールの質量を量ってみました。

マグネシウム・鉄の燃焼は次の化学反応式で表せます。「燃焼は熱や光を出しながら急激に進む酸化反応」、酸素と化合してまぶしい光を出し、大量の熱を出して酸素と化合します。


計算してみると化学反応式のとおりに進めば鉄は約1.38倍に質量が増加するはずです。みんなの実験結果は…1.1倍~1.4倍くらいでした。良い結果だと思います。理論値より少ないのは燃え切っていない鉄が残っているからか?みんなで考察しました。
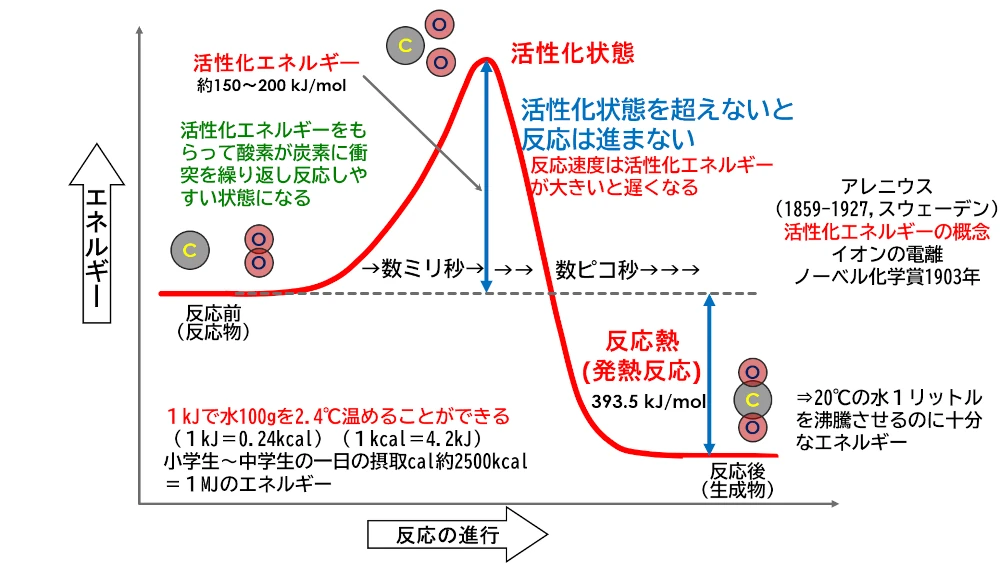
さて、燃焼のことが少しずつ分かってきました。でも酸化反応なら、可燃物と酸素があるだけでも反応が進みそうなのにどうして混ざっただけでは燃焼は進まないのでしょう。スウェーデンの化学者アーレニウスが活性化エネルギーというものを提唱しました。アレニウスは酸とアルカリ、pHの学習をしたときに登場しました。
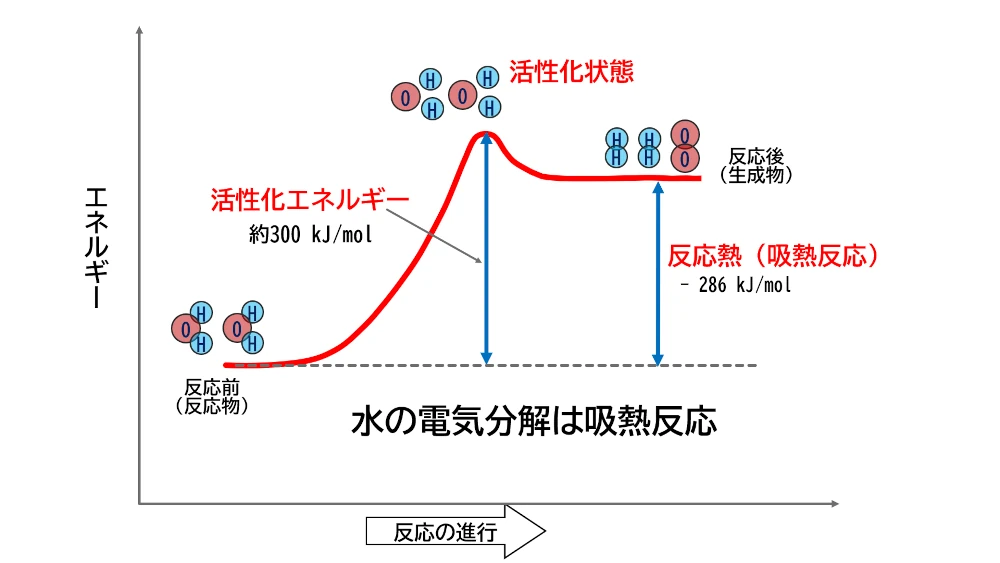
上の図は、化学反応が進むには反応物があるだけではだめで、活性化エネルギーをこえるためのエネルギーが供給されないと進まないということを示しています。燃焼の場合、ライターの火などの点火するエネルギーが、この活性化エネルギーを超えるためのエネルギーとなっています。一旦活性化エネルギーを超えた燃焼の化学反応は、酸素との化合によって放出する熱が次の反応の活性化エネルギーとなって、改めてライターで火をつけなくても燃焼が継続していきます。化学反応の中には、発熱反応ばかりではなく、吸熱反応もあり、化学反応を継続するためには、エネルギーを供給し続ける必要があります。

3 酸化反応と発熱
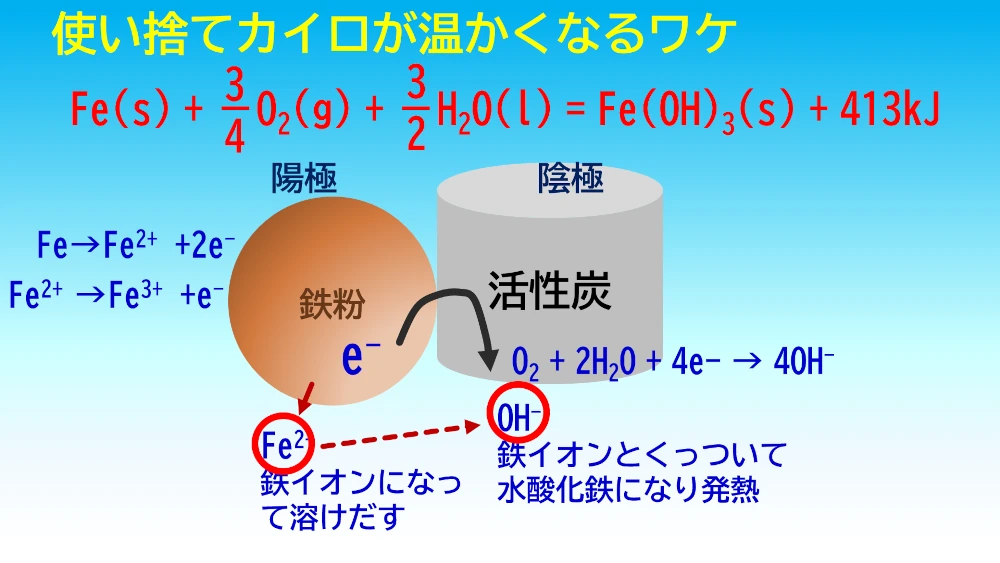
最後に、酸化反応による発熱について実験で確認していきます。燃焼は酸化反応の一部、でも酸化反応すべてが燃焼ではありません。ゆっくりと進む酸化反応もあります。光を放出しない酸化反応は沢山あります。でも、多くの酸化反応が発熱を伴います。今回は、鉄粉、活性炭、食塩水で使い捨てカイロを作ってみました。


食塩1gに水5mLを加えて食塩水をつくります。お茶パックの袋に活性炭を入れ、食塩水を均等に振りかけます。そこに鉄粉を加え、お茶パックの袋を5重にして包みます。これをジッパー付きビニール袋へ入れてふりまぜ、温度計で温度変化を観察します。
70℃くらいまで温度が上がりました。ジッパー袋を閉じて空気が入らないようにすると温度が下がり始め、袋を開けて空気を入れると再び温度が上がり始めます。使い捨てカイロの発熱の仕組みは、鉄粉の酸化による発熱です。ふつうは鉄が錆びるのには時間がかかるし、感じるほどの発熱もありません。ところが、活性炭と食塩水によって、鉄の酸化反応が促進され、発熱が起こります。鉄の酸化反応に必要な活性化エネルギーは、この活性炭と食塩水によって下げられ、まぜるだけで急速に進んでいきます。活性炭と食塩水は触媒作用をしていて、活性化エネルギーを下げています。この仕組みは次回の電池の章で説明します。実は局部的に電池ができていてこの電気化学的な反応が鉄の酸化反応を進めています。

たった数本のろうそくの炎からいろいろなことが分かりました。燃えるということ、そこでどんな化学変化が起こっているか、身近な現象の中に化学の世界が広がっています。